Hvor mutasjoner feiler
(fra 'Theistic Evolution - a Scientific, Philosophical and Theological critique, kap.7)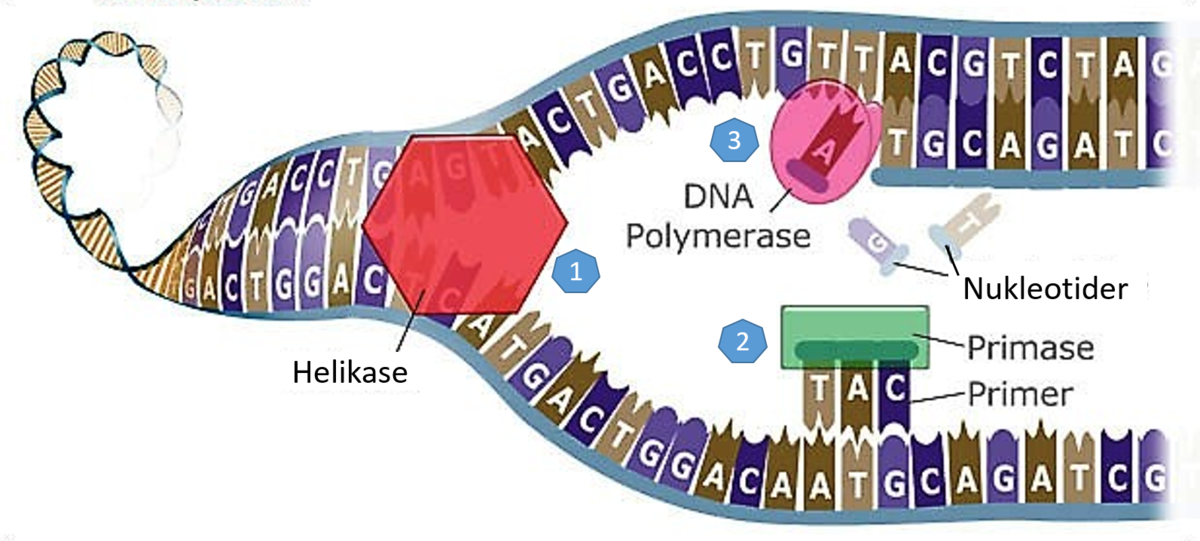
I. A. Sentraldogmet i neo-darwinismen
Da Watson og Crick publiserte sin modell for kjemisk struktur til DNA i 1953 bemerket de at modellen "foreslår en mulig kopieringsmekanisme for det genetiske materialet." Etter en måned hadde de konkretisert det til: "Vår modell for deoxyribonucleid-syre, er .. et par av maler, der hver utgjør den komplementære del til den andre. Vi forestiller oss at forut for duplisering .. nøstes de to malen opp og skiller lag. Så fungerer hver kjede som mal for å danne en ny komplementær del til seg selv, så at til slutt vil vi ha to par av kjeder -- der vi før bare hadde én. Sekvensen i baseparene vil ha blitt nøyaktig kopiert." (9) Denne hypotesen ble senere bekreftet av biologene M. Meselson og Fr. Stahl som publiserte eksperimentelle bevis for at DNA molekyler dupliserte seg akkurat som Watson og Crick foreslo.
Bilde 1. Watson og Crick traff bra..
I 1955 oppdaget den rumenske biologen G. Palade mikroskopise partikler i cellen som senere ble kalt ribosomer. Pallade og andre viste deretter at ribosomer var stedet der proteiner ble dannet i celler. I 1956 oppdaget E. Volkin og L. Asrachan det de kalte "DNA-like" ribonukleotider (RNA), som tjente i en formidlerrolle (budbringer /messenger-RNA) mellom DNA og protein-syntese. (12)
I 1958 foreslo Fr. Crick at spesifisiteten i DNA-sekvensen ligger bare i nukleotid-sekvensen dens, som så koder en tilsvarende sekvens av budbringer RNA, som i sin tur igjen opererer som mal for aminosyre-sekvensen til et protein. Crick foreslo at informasjonen i DNA-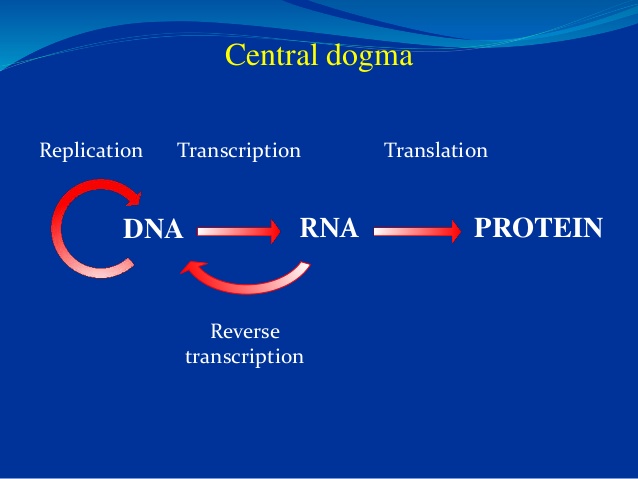 sekvenser kan bli overført fra DNA til protein, men ikke tilbake igjen. --Senere kalt for sentraldogmet i molekylær biologi.
sekvenser kan bli overført fra DNA til protein, men ikke tilbake igjen. --Senere kalt for sentraldogmet i molekylær biologi.
Det ovenstående har fått mange folk til å tro at DNA dermed besitter et 'genetisk program'som spesifiserer de prinsipielle trekkene ved en organisme. James Watson skrev i en college lærebok (1987) at "vi vet at instruksjonene for hvordan egget utvikler seg til en voksen er skrevet i den lineære base-sekvensen langs DNA-et." (15) Biolog Fr. Collins skrev i 2006 at vårt DNA er et "forbløffende script, som bærer i seg alle instruksjonene for å bygge et menneske." (16) Enkelt sagt innebærer sentraldogmet at "DNA lager RNA, som lager proteiner, som lager oss."
Bilde 2. Illustrasjon av sentraldogmet
Det har vært mange kritikere av sentraldogmet. En prominent kritiker biologisk-historiker Ev. Fox Keller skrev i 2000: --Informasjonsinnholdet i DNA forblir essensielt --uten da kan ikke utvikling (livet selv) fortsette. Men nåværende forskning, i et antall biologiske disipliner, har begynt å legge betydelig press på biologer til å rekonseptualisere programmet for utvikling som noe betydelig mer komplekst enn ett sett instruksjoner skrevet i 'nukleotid-alfabetet'. (17)
Likevel har sentraldogmet blitt veldig populært. En grunn er at det er konsistent med neo-darwinistisk teori. Som Jacques Monod én gang sa, med sentraldogmet "og [med] forståelsen av den tilfeldig fysiske basis for mutasjoner som molekylærbiologien også har forsynt, er mekanismen i darwinismen endelig sikkert grunnfestet. Og mennesket må forstå at han er bare et ulykkestilfelle." (18)
B. Epigenetikk
Likevel vet alle biologer, også de som tror på det sentrale dogmet, at stien fra genotype til fenotype er berørt av andre faktorer. Det greske 'epi' har bl.a. betydningene 'over', 'i tillegg til' . . I 1942 fremmet den britiske biologen C. Waddington at termen 'epigenetikk' innebar studiet av "prosessene involver i mekanismen som gener i genotypen frembringer fenotype endringer i gjennom." (19) Men tre år 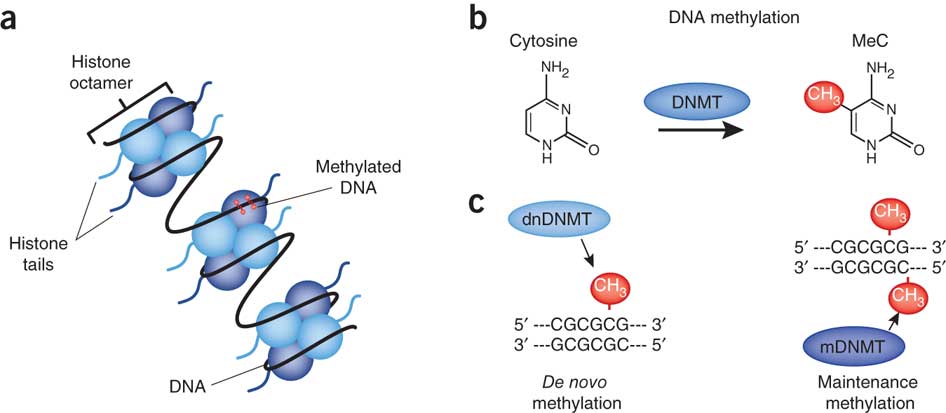 tidligere hadde Waddington benyttet termen 'epigenotype' for mer bredt å referere til "settet av organisatører og organiserende relasjoner som et spesifikt vevstykke vil bli gjenstand for, gjennom sin utvikling." (20) Så epigenetikk har hatt ulike betydninger siden starten. I en snever betydning referer det til mekanismene som DNA produserer fenotype effekter gjennom. I en bredere betydning, refererer det til alle faktorer involvert i utviklingen, der DNA er én av dem.
tidligere hadde Waddington benyttet termen 'epigenotype' for mer bredt å referere til "settet av organisatører og organiserende relasjoner som et spesifikt vevstykke vil bli gjenstand for, gjennom sin utvikling." (20) Så epigenetikk har hatt ulike betydninger siden starten. I en snever betydning referer det til mekanismene som DNA produserer fenotype effekter gjennom. I en bredere betydning, refererer det til alle faktorer involvert i utviklingen, der DNA er én av dem.
De fleste biologer benytter nå epigenetikk i en smal betydning, for å referere til arvelige endringer i et kromosom som ikke endrer DNA-sekvensen. I 2007 skrev biolog J. Keefer: "Epigenetikk er studiet av arvelige endringer i gen funksjoner som inntreffer uavhengig av endringer i primære DNA-sekvenser. De best studerte endringene er DNA metylering og endringer i kromatin strukturer ved histon modifikasjon, og histon utveksling." (21)
Bilde 3. a. DNA-oppkveilet i histoner b. DNA-metylering
I DNA metylering, knytter en metylgruppe som består av et karbon-atom og tre hydrogenatomer kjemisk til en base i DNA og påvirker derved hvorvidt det strekket av DNA blir transkribert. Kromatin er kombinasjon av DNA og proteiner, som utgjør et kromosom, og de viktigste proteinene kalles histoner. Histoner komprimerer det lange DNA-molekylet ved å tjene som spoler, som DNA da vinder seg rundt. Flere ulike molekyler kan modifisere histoner ved å binde seg kjemisk til dem, for derved å endre kromosom struktur og påvirke DNA-transkribering. Videre er det flere slags histoner med ulike egenskaper og molekylære 'anstander' kan bytte ut noen med andre.
DNA metylering, histon modifikasjon og histon utveksling hjelper å bestemme når og hvor spesifikke DNA-sekvenser blir transkribert til RNA. Men epigenetikk i denne snevre betydning lar sentral-dogmet forbli intakt. Imidlertid fortsetter noen biologer å forstå epigenetikk i en mer bred betydning. I 1993 skrev S. Herrring: "Vidt sett refererer epigenetikk til hele serien av interaksjoner blant celler og celleprodukter" som fører til embryo-utvikling. (22) I 2002 skrev E. Jablonka og M. Lamb at epigenetikk "hovedsakelig er beskjeftiget med mekanismene hvorved cellene blir knyttet til en spesifikk form eller funksjon." De konkluderte " Ved å gjenkjenne at det er epigenetiske arvelige systemer, gjennom hvilke ikke-DNA variasjoner kan bli overført i celle og organisme-avstamning, utvider arv-begrepet og utfordrer den bredt aksepterte gen-sentrerte neo-darwinistiske versjon av darwinismen. Den bredere versjon av epigenetikk impliserer at det er lag av informasjon som er uavhengig av DNA, og det er det virkelig.
II. Hvorfor sentraldogmet feiler
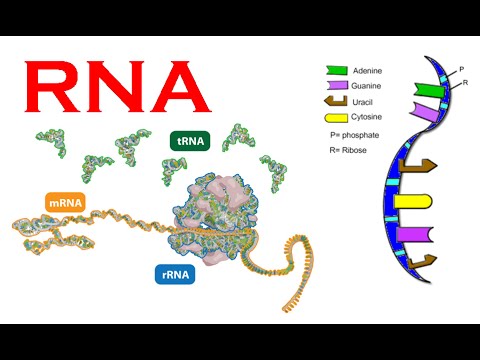
I følge sentraldogmet spesifiserer DNA messenger-RNA, som igjen spesifiserer proteiner, som igjen spesifiserer organismen. Likevel er mange messenger(m)-RNA ikke fullstendig spesifisert ved DNA-sekvenser og mange proteiner er ikke fullstendig spesifisert ved messenger-RNA.
Bilde 4. Typer og oppbygning av RNA
A. DNA spesifiserer ikke mange RNA
Etter en DNA sekvens er transkribert til RNA, kan flere prosesser modifisere RNA'et slik at det ikke matcher det originale transskriptet. To godt studerte prosesser er RNA-spleising og RNA-editering.
1. RNA-spleising
I plante og dyreceller, er de fleste DNA-sekvenser som koder for proteiner avbrutt av DNA-strekk som ikke koder for noe protein. Førstnevnte kalles eksoner og sistnevnte kalles for introner. Når DNA blir transkribert, vil eksoner og introner inkluderes i messenger-RNA som vil tjene som mal for protein, men intronene blir så utelatt og eksonene blir spleiset tilbake sammen. Men én eller flere av eksonene kan bli utelatt eller ødelagt, så det endelige messenger-RNA har en sekvens som ikke lenger svarer til den opprinnelige DNA-sekvensen. Dette kalles alternativ spleising og med det kan celler lage tusenvis av flere m-RNA og proteiner enn det som er kodet i DNA-sekvensen. Én DNA-sekvens hos bananfluer genererer flere enn 18 tusen ulike proteiner gjennom alternativ spleising. (24)
I 2010 rapporterte et team av molekylær-biologer at m-RNA transkripter " fra omtrent 95% av multi-ekson menneskelige gener, blir spleiset på mer enn én måte. Og i de fleste tilfeller ble de resulterende transkriptene ulikt uttrykt innen forskjellige celler og vevstyper." (25) Forskjellen som produseres ved alternativ spleising har funksjonelle konsekvenser. Bl.a. regulerer ulike spleisinger fysiologiske endringer og nerve-utvikling, og det produserer enorm ulikhet i membran-proteiner.
2. RNA-editering
I tillegg til alternativ spleising kan mange dyre-transkripter gjennomgå RNA-editering, som kan modifisere eksisterende nukleotider eller sette noen i tillegg. Editering av ett m-RNA kan påvirke aminosyre-sekvensen for proteinet det koder for, slik at proteiner skiller seg fra det DNA spesifiserte. Nylige studier har avdekket omfattende RNA-editering i mennesker. (26) RNA-editering, i likhet med RNA-spleising, har funksjonelle konsekvenser. Det er vidt utbredt i dyrs nervesystemer, der det modifiserer m-RNA i proteiner, involvert i dyre-signalering. I mus, er RNA editering nødvendig for overlevelse av stam-celler som genererer modne blod-celler. En har tilfeller av funksjonell editering av RNA i blekksprutarter, slik at de bedre kan tilpasses sitt miljø (kulde/farge-tilpasninger etc)
Bilde 5. RNA-editering
 B. m-RNA spesifiserer ikke endelig form for mange proteiner
B. m-RNA spesifiserer ikke endelig form for mange proteiner
Funksjonen til et protein-molekyl avhenger av dets tre-dimensjonale form, som bestemmer av hvordan det lineære molekylet folder seg sammen. Selv om amino-syre sekvensen ofte bestemmer foldingen, skjer det ikke alltid. Mange faktorer i cellen, f.eks. grad av molekylær-tetthet i cellen kan påvirke hvordan proteinet folder seg. Noen proteiner adopterer like foldings-former, til tross for ulike aminosyre-sekvenser. (28) Andre antar ulike foldinger, til tross for identiske eller nesten like aminosyre-sekvenser. Ett velkjent eks. på det siste er prioner, som misformede proteiner, som er sykdomsfremkallende og arvelige. Men det er også ikke-sykdomsfremkallende proteiner, der samme aminosyre-sekvens kan foldes i mer enn en form. Disse kalles 'metamorfe' proteiner. (29)
Noen proteiner er i seg selv uordnede. Ca. 20-30% av proteiner i pattedyr-celler er uten iboende ordnet 3-dimensjonal struktur. De adopterer foldede strukturer bare etter samvirke med andre molekyler. (30) Iboende uordnede proteiner spiller viktige roller i å regulere membran-kanaler og tjener som nav i intracellulære nettverk.
C. De fleste proteiner er modifisert ved glykolsylasjon
Endelig er de fleste plante og dyre - celler kjemisk modifisert etter oversettelse, ved en prosess som kalles 'glykolsylasjon' (se her); som involverer tilførsel av 'glykaner'. Glykaner (av et gresk ord for søtsaker) er sammensatt av mange små sukkerformer, kjemisk bundet til hverandre, og de kan være ekstremt komplekse. I levende celler er nukleotidene i DNA linket til hverandre i lineære kjeder (med få unntak), det samme gjelder aminosyrer i proteiner. Men sukker kan linkes til hverandre på flere ulike måter. F.eks. kan glukose-molekyler linke til andre sukkertyper på seks ulike steder. Som følge kan sukker danne forgrenede kjeder, som er mye mer sammensatte enn lineære kjeder av nukleotider eller aminosyrer.
Betrakt molekyler som inneholder bare seks underenheter: men 4 nukleotider kan linkes sammen til å danne maksimum ca. fire tusen ulike molekyler, og 22 aminosyrer kan lenkes til å danne max. ca 100 millioner ulike molekyler, så kan de dusin sukkerarter som vi vanligvis finner i levende celler, kan teoretisk danne mer enn 1 billion ulike molekyler. (31) Den informasjons-bærende kapasiteten ved glykaner overstiger altså klart de kombinerte kapasiteter til DNA og proteiner.
I glykosylasjon blir et glykan først tilsatt til et protein i løpet av, eller etter, proteinsyntesen. De komplette, enzym-nettverkene, som involverer dusinvis av interagerende proteiner, modifiserer glykaner i forhold til cellens behov. Den resulterende endringen setter cellen i stand til å tilpasse seg til en gitt omgivelse eller konfigurere den for et gitt stadium i embryo-utviklingen. Den endelige, glykosylerte formen til et protein, er således meget lang fra den direkte spesifisering ved DNA-sekvensen. Som flere biokjemikere har uttrykt det, er endring til proteiner gjennom enzmatisk glykosylasjon "en begivenhet som strekker seg langt utover genomet." (32) Den "forsyner et tilleggsnivå av informasjonsinnehold i biologiske systemer." (33) Faktisk kan det bane vei for en slags "kvante-mekanisk revolusjon i biologien, på samme måte som den som 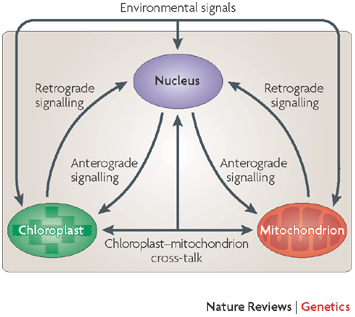 revolusjonerte fysikken på starten av det 20. århundre." (34)
revolusjonerte fysikken på starten av det 20. århundre." (34)
Så de to første stegene i det sentrale dogmet feiler: DNA spesifiserer ikke fullt ut m-RNA og m-RNA spesifiserer ikke fullt ut proteiner. Men mest avgjørende feiler det sentrale dogmet i dets tredje og avgjørende steg: proteiner spesifiserer ikke en organisme.
Bilde 6. Signalering innen cellen
Artikkelen fortsetter her.
Referanser:
9. J. Watson og Fr. Crick, "Genetical Implications of the Structure of Deoxyribonucleic Acid," Nature 171, (1953): 964-967
12. A. Weinberg, Messenger RNA: "Origin of a Discovery," Nature 414 (2001) 485
15. J. Watson og N. Hopkins et al, Molecular Biology of the Gene, 4.utg. (Menlo Park; CA: Benjamin/Cummings, 1987), 747
16. Fr. Collins, The Language of God (NY: Free Press, 2006, 2.
17. E. F. Keller, The Century of the Gene (Cambridge, MA: Harvard UP, 2000), 87
18. Judson, Eighth Day of Creation, 217
19. C.H. Waddington, "The Epigenotype," Endeavour 1 (1942); 18-20
Bilde 7. Transkripsjons-maskineri
 20. C.H. Waddington, An Introduction to modern Genetics (London: G.Allen & Unwin, 1939), 156
20. C.H. Waddington, An Introduction to modern Genetics (London: G.Allen & Unwin, 1939), 156
21. J.C. Kiefer, "Epigenetics in Development," Development Dynamics 236 (2007): 1144-1156
22. S.W. Herring, "Formation of the Vertebrate Face: Epigenetic and Functional Influences," American Zoologists 33 (1993): 472-483
24. W. Sun, X. You et al, "Ultra-Deep Profiling of Alternative Spliced Drosophila Dscam Isoforms by Circ-Ass. Multi-Segment Sequencing," EMBO Journal 32 (2013):2029-2038
25. Y. Barash, J.A. Cararco et al, "Deciphering the Splicing Code," Nature 456 (2010): 53-59
26. J. Hoon Bahn et al, "Genomic Analysis of ADAR1 Binding and Its Involvement in Multiple RNA Processing Pathways," Nature Comm. 9 (2015): 6355
28. R.B. Russell og G.J: Barton, "Structural Features Can be Unconcerved in Protein with Similar Folds," Journal om Molecular Biology 244 ( 1994):332-350
29. A.G. Murzin, "Metamorphic Proteins," Science 320 (2008): 1725-1726
30. F. U. Hartl, A. Bracher et al, "Molecular Chaperones in Protein Folding og Proteostasis," Nature 475 (2011): 324-332
31. R.A. Laine, "A Calculation of All Possible Oligosaccharide Isomers Both Branched and Linear Yields, 1.05*10^12, GlychoBiology 4 (1994): 759-767
32. R.G. Spiri, "Protein Glycosylation: NAture, Distr. Enzymatic Formation, and Disease Implications of Glycopeptide Bonds," GlychoBiology 12 (2002): 43R-56R
33. K. W. Moremen et al, "Vertebrate Protein Glococylation: Diversity, Synthesis and Function," Nature Reviews Molecular Cell Biology 123(2012): 448-462
34. Gordan Lauc et al, "Epigenetic Regulation of Glycosylation is the Quantum Mechanics of Biology," Biochimica et Biopphysica Acta 1840 (2014): 65-70
Ansvarlig for oversettelse og bilder ved Asbjørn E. Lund

 sekvenser kan bli overført fra DNA til protein, men ikke tilbake igjen. --Senere kalt for sentraldogmet i molekylær biologi.
sekvenser kan bli overført fra DNA til protein, men ikke tilbake igjen. --Senere kalt for sentraldogmet i molekylær biologi.  tidligere hadde Waddington benyttet termen 'epigenotype' for mer bredt å referere til "settet av organisatører og organiserende relasjoner som et spesifikt vevstykke vil bli gjenstand for, gjennom sin utvikling." (20) Så epigenetikk har hatt ulike betydninger siden starten. I en snever betydning referer det til mekanismene som DNA produserer fenotype effekter gjennom. I en bredere betydning, refererer det til alle faktorer involvert i utviklingen, der DNA er én av dem.
tidligere hadde Waddington benyttet termen 'epigenotype' for mer bredt å referere til "settet av organisatører og organiserende relasjoner som et spesifikt vevstykke vil bli gjenstand for, gjennom sin utvikling." (20) Så epigenetikk har hatt ulike betydninger siden starten. I en snever betydning referer det til mekanismene som DNA produserer fenotype effekter gjennom. I en bredere betydning, refererer det til alle faktorer involvert i utviklingen, der DNA er én av dem.
 B. m-RNA spesifiserer ikke endelig form for mange proteiner
B. m-RNA spesifiserer ikke endelig form for mange proteiner revolusjonerte fysikken på starten av det 20. århundre." (34)
revolusjonerte fysikken på starten av det 20. århundre." (34)  20. C.H. Waddington, An Introduction to modern Genetics (London: G.Allen & Unwin, 1939), 156
20. C.H. Waddington, An Introduction to modern Genetics (London: G.Allen & Unwin, 1939), 156